SUT Tebliğinde değişiklik yapıldı
Sosyal Güvenlik Kurumu Sağlık Uygulama Tebliğinde Değişiklik Yapılmasına Dair Tebliğ

9 Eylül 2017 CUMARTESİ
Resmi Gazete
Sayı : 30175
TEBLİĞ
Sosyal Güvenlik Kurumu Başkanlığından:
SOSYAL GÜVENLİK KURUMU SAĞLIK UYGULAMA TEBLİĞİNDE
DEĞİŞİKLİK YAPILMASINA DAİR TEBLİĞ
MADDE 1 - 24/3/2013 tarihli ve 28597 sayılı Resmi Gazete' de yayımlanan Sosyal Güvenlik Kurumu Sağlık Uygulama Tebliğinin 1.5.1 numaralı maddesinin birinci fıkrasının ilk cümlesinde yer alan "(1), (3) ve (9)" ibaresi "(1) ve (3)" şeklinde ve ikinci cümlesinde yer alan "60/c-1, 60/c-3 veya 60/c-9" ibaresi "60/c-1 veya 60/c-3" şeklinde değiştirilmiştir.
MADDE 2 - Aynı Tebliğin 1.9.3 numaralı maddesinin birinci fıkrasının ikinci cümlesinde ve aynı fıkranın (h) bendinde yer alan "EK-2/C Listesindeki" ibarelerinden sonra gelen "Koklear" ibareleri "işitsel" şeklinde değiştirilmiştir.
MADDE 3 - Aynı Tebliğin 2.4.1 numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) 2.4.1.A numaralı maddesinin birinci fıkrasının dördüncü cümlesinde yer alan "işlemler" ibaresi ile "ve vakıf üniversiteleri" ibaresi yürürlükten kaldırılmıştır.
b) 2.4.1.B numaralı maddesinin birinci fıkrasının ilk cümlesinde yer alan "60/c-1, 60/c-3 veya 60/c-9" ibaresi "60/c-1 veya 60/c-3" şeklinde değiştirilmiştir.
MADDE 4 - Aynı Tebliğin 2.4.4.F-2 numaralı maddesinin üçüncü fıkrasının birinci cümlesinde yer alan "ve genel sağlık sigortalısı ile bakmakla yükümlü olduğu kişilerden" ibaresi "3713 sayılı Kanun kapsamına girmese dahi atış, tatbikat veya diğer ateşli silah yaralanmaları nedeniyle malul olan vazife ve harp malullerine" şeklinde değiştirilmiştir.
MADDE 5 - Aynı Tebliğin 2.4.4.F-3 numaralı maddesinin birinci fıkrasının (b) bendinde yer alan "gözetiminde" ibaresi "sorumluluğunda" şeklinde değiştirilmiştir.
MADDE 6 - Aynı Tebliğin 2.4.4.F-4 numaralı maddesinin üçüncü fıkrasının sonuna aşağıdaki cümle eklenmiştir.
"2.4.4.F-2(5) fıkrasında belirtilen fizik tedavi ve rehabilitasyon tedavileri için uygulanan, sağlık raporu sayısı, bölge, seans kontrolleri hesaba katılmaz."
MADDE 7 - Aynı Tebliğin 2.4.4.F-6 numaralı maddesi aşağıdaki şekilde yeniden düzenlenmiştir.
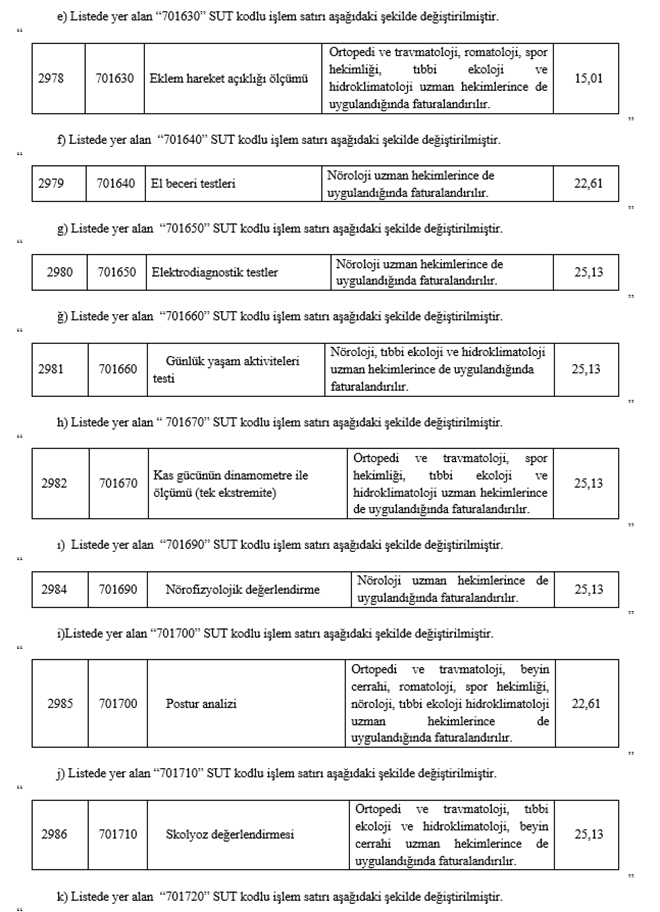
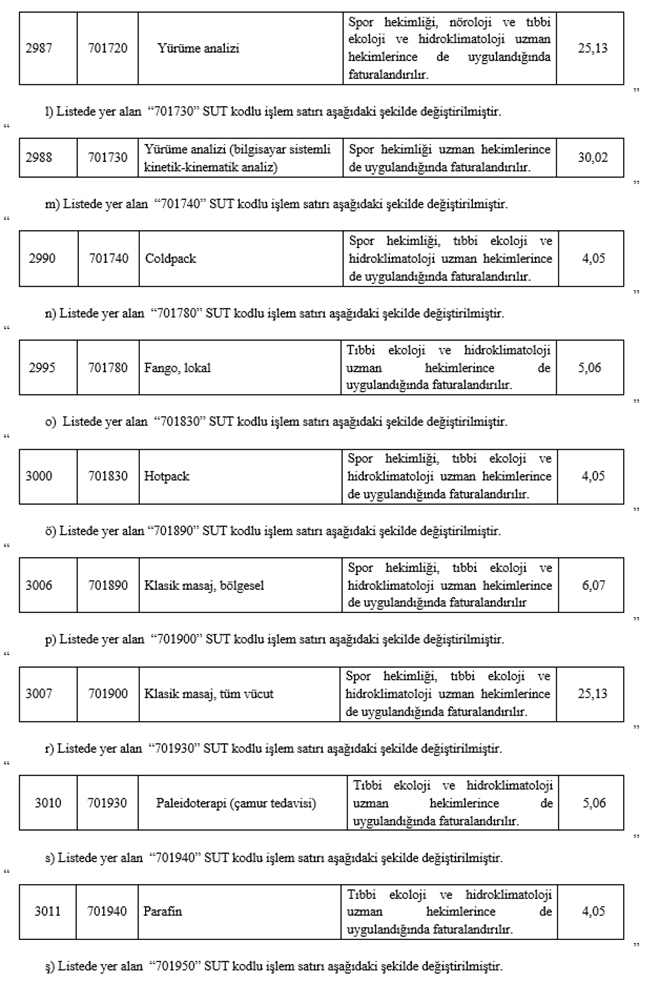
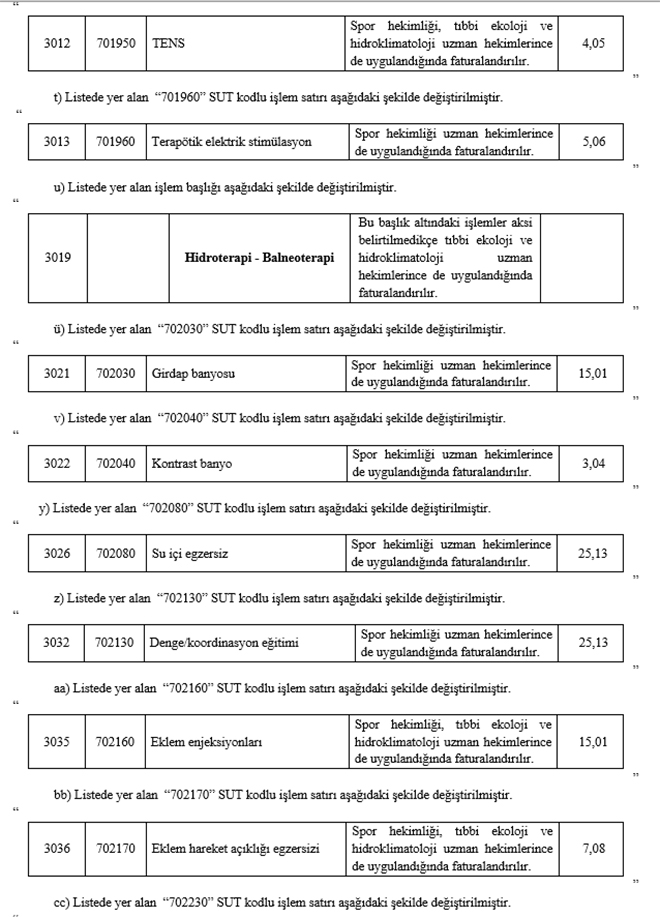
"2.4.4.F-6 - Spor hekimliği ile tıbbi ekoloji ve hidroklimatoloji uygulamaları
(1) Resmi sağlık kurumlarında görevli; spor hekimlerince sunulan spor hekimliği uygulamalarının bedelinin Kurumca karşılanabilmesi için bu hekimler tarafından, tıbbi ekoloji ve hidroklimatoloji uzman hekimlerince sunulan tıbbi ekoloji ve hidroklimatoloji uygulamalarının Kurumca bedelinin karşılanabilmesi için bu uzman hekimler tarafından sağlık raporu düzenlenmesi gereklidir. Düzenlenecek raporda uygulanacak tedavi ve tedavi süresi belirtilecektir.
(2) Bir hasta için son bir yıl içinde en fazla; aynı bölgeden toplam 30 seans, iki farklı vücut bölgesinden toplam 60 seans fizik tedavi ve rehabilitasyon uygulamalarına ait bedeller Kurumca karşılanır. Aynı bölge için bir yıl içinde en fazla iki sağlık raporu düzenlenebilir. Bölge, seans ve sağlık raporu sayılarının kontrollerinde 2.4.4.F-2(5) fıkrasında belirtilen bölge, seans ve sağlık raporu sayıları da hesaba katılır.
(3) Spor hekimliği ile tıbbi ekoloji ve hidroklimatoloji uzman hekimlerince SUT eki EK-2/D-2 Listesinde yer alan tanılarda yapılan fizik tedavi ve rehabilitasyon uygulamaları SUT eki EK-2/C Listesindeki "P915030" kodlu işlem puanı esas alınarak faturalandırılır."
MADDE 8 - Aynı Tebliğin 2.4.4.K numaralı maddesinin birinci fıkrasında yer alan "U1 ve U2" ibaresi "U1, U2 ile U4" şeklinde değiştirilmiş ve yedinci fıkrasının sonuna aşağıdaki cümle eklenmiştir.
"Palyatif bakım tedavisine tanı ve tedavi kapsamında yapılan tüm işlemler dahil olup ayrıca faturalandırılamaz."
MADDE 9 - Aynı Tebliğin 2.6.1 numaralı maddesine aşağıdaki fıkra eklenmiştir.
"(2) 3713 sayılı Kanuna göre aylık bağlanmış maluller, 5434 sayılı Türkiye Cumhuriyeti Emekli Sandığı Kanununun 56 ncı maddesi veya 2330 sayılı Kanunun 2 nci maddesinin birinci fıkrasının (e) ve (f) bentlerinde sayılanlardan 3713 sayılı Kanun kapsamına giren olaylar sebebiyle aylık bağlananlar ile 3713 sayılı Kanun kapsamına girmese dahi başkasının yardımı ve desteği olmaksızın yaşamak için gereken hareketleri yapamayacak derecede malul olan vazife ve harp malulü hastalar, 3713 sayılı Kanun kapsamına girmese dahi atış, tatbikat veya diğer ateşli silah yaralanmaları nedeniyle malul olan vazife ve harp malulleri, tedavileri sonuçlanıncaya veya maluliyetleri kesinleşinceye kadar geçen süre içerisinde 3713 sayılı Kanunun 21 inci maddesinde sayılan olaylara maruz kalmaları nedeniyle yaralanan kişilerin yerleşim yeri dışına sevki için birinci fıkranın (a) bendinde yer alan şartlar aranmaz."
MADDE 10 - Aynı Tebliğin 2.6.1.A numaralı maddesine aşağıdaki fıkra eklenmiştir.
"(6) 3713 sayılı Kanuna göre aylık bağlanmış maluller, 5434 sayılı Türkiye Cumhuriyeti Emekli Sandığı Kanununun 56 ncı maddesi veya 2330 sayılı Kanunun 2 nci maddesinin birinci fıkrasının (e) ve (f) bentlerinde sayılanlardan 3713 sayılı Kanun kapsamına giren olaylar sebebiyle aylık bağlananlar ile 3713 sayılı Kanun kapsamına girmese dahi başkasının yardımı ve desteği olmaksızın yaşamak için gereken hareketleri yapamayacak derecede malul olan vazife ve harp malulü hastalar, 3713 sayılı Kanun kapsamına girmese dahi atış, tatbikat veya diğer ateşli silah yaralanmaları nedeniyle malul olan vazife ve harp malulleri, tedavileri sonuçlanıncaya veya maluliyetleri kesinleşinceye kadar geçen süre içerisinde 3713 sayılı Kanunun 21 inci maddesinde sayılan olaylara maruz kalmaları nedeniyle yaralanan kişiler için birinci fıkrada yer alan şartlar aranmaz."
MADDE 11 - Aynı Tebliğin 2.6.9 numaralı maddesinin altıncı fıkrasında yer alan "(1), (3) ve (9)" ibaresi "(1) ve (3)" şeklinde değiştirilmiştir.
MADDE 12 - Aynı Tebliğin 3.1.2 numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Onuncu fıkrasının sonuna aşağıdaki bent eklenmiştir.
"c) Sürekli kullanılan tıbbi malzemelere ilişkin düzenlenen sağlık raporlarına istinaden temin edilen tıbbi malzeme reçeteleri, Kurum kayıtlarında yer alan malzeme bitim tarihinden 15 gün öncesine kadar düzenlenebilir."
b) On yedinci fıkrasının (a) ve (b) bentleri aşağıdaki şekilde yeniden düzenlenmiştir.
"a ) SUT ve eki listelerinde yer alan tıbbi cihazları temin etmeleri halinde fatura bedelleri SUT ve eki listelerde yer alan fiyatları aşmıyor ise bu fiyatlar üzerinden Kurumca karşılanır.
b) SUT' ta yer alan fiyatlarla temin edilemeyen ortez/protez ve diğer iyileştirici araç ve gereçler ile SUT' ta yer almayan her türlü ortez/protez ve diğer iyileştirici araç ve gereçlere, Sağlık Bakanlığı Sağlık Bilimleri Üniversitesi Gaziler Fizik Tedavi ve Rehabilitasyon Eğitim ve Araştırma Hastanesi ile yapılacak protokol/sözleşme kapsamında, bu hastanede oluşan ve/veya oluşturulacak komisyon/kurulca ihtiyacı olduğunun tespit edilmesi ve ihtiyacın hastanece karşılanarak Kuruma faturalandırılması halinde fatura tutarı üzerinden ödenir."
MADDE 13 - Aynı Tebliğin 3.2.1.B numaralı maddesinin birinci fıkrasının ikinci cümlesinde yer alan "işletme gideri," ibaresi yürürlükten kaldırılmış, aynı fıkraya birinci cümlesinden sonra gelmek üzere aşağıdaki cümle eklenmiştir.
"Bu fiyatlara Kurum bilgi işlem sistemi tarafından %12 işletme gideri ilave edilir."
MADDE 14 - Aynı Tebliğin 4.1.2 numaralı maddesinin üçüncü fıkrasında yer alan "tüberküloz ilaçları" ibaresinden sonra gelmek üzere ", kür protokolü uygulanan ilaçlarda ise 1 küre yetecek miktarda kemoterapi ilaçları" ibaresi eklenmiştir.
MADDE 15 - Aynı Tebliğin 4.2.1.A numaralı maddesinin birinci fıkrasında yer alan "hastalığın diğer hastalık modifiye edici ilaçlardan sulfasalazin veya methotrexat ile kontrol altına alınamadığı veya bu ilaçların kullanımının kontrendike olduğu veya yan etki nedeniyle kullanılamadığı durumlarda," ibaresi yürürlükten kaldırılmıştır.
MADDE 16 - Aynı Tebliğin 4.2.1.C-8 numaralı maddesi aşağıdaki şekilde değiştirilmiştir.
"4.2.1.C-8 - Vedolizumab
(1) Fistülize, şiddetli veya aktif luminal Crohn hastalığında; en az bir anti TNF tedavisine rağmen hastalığı kontrol edilemeyen hastalarda, ilacın başlangıç tedavileri sonrasında idame dozunun sekiz haftada bir 300 mg olması koşuluyla, ilacın kullanım dozu ve kullanım süresini belirten 4 ay süreli sağlık kurulu raporuna dayanılarak tedaviye başlanır. Tedavinin 4 üncü ayında tedaviye cevap alınamaması (hastalığa yanıt kriteri: Crohn Hastalık Aktivite İndeksi' nde 70 puanlık düşüşün olmaması) durumunda tedavi kesilir. Crohn Hastalık Aktivite İndeksi' nde 70 puan üzerinde düşüş olması halinde, ilacın dozu ve süresinin belirtildiği 6 ay süreli sağlık kurulu raporuna dayanılarak tedaviye devam edilebilir. Sağlık kurulu raporunda, gastroenteroloji, genel cerrahi uzman hekimlerinden en az biri yer almalıdır. Sağlık kurulu raporlarına dayanılarak, bu hekimler ile iç hastalıkları uzman hekimlerince reçete edilir ve sağlık kurum/kuruluşlarında klinik koşullarda uygulanır.
(2) Ülseratif kolit hastalığında; en az bir anti TNF tedavisine rağmen hastalığı kontrol edilemeyen hastalarda, şiddetli aktif ülseratif kolit bulgularının devam etmesi halinde, ilacın başlangıç tedavileri sonrasında idame dozunun sekiz haftada bir 300 mg olması koşuluyla, üçüncü basamak sağlık kurumlarında bu durumun belirtildiği gastroenteroloji uzman hekimi veya genel cerrahi uzmanı tarafından düzenlenecek 6 ay süreli uzman hekim raporuna dayanılarak, bu uzman hekimler ve iç hastalıkları uzman hekimlerince reçete edilir."
MADDE 17 - Aynı Tebliğin 4.2.6.B numaralı maddesinde yer alan "En az bir" ve "sağlık kurulu raporu ile" ibarelerinden sonra gelmek üzere "çocuk endokrinolojisi ve metabolizma hastalıkları veya" ibaresi eklenmiştir.
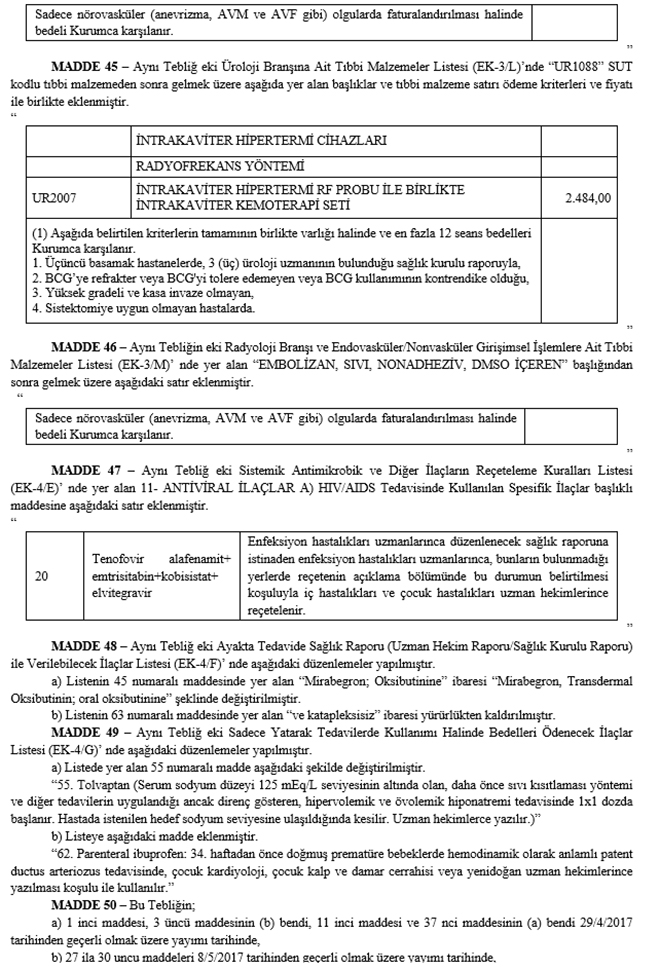
MADDE 18 - Aynı Tebliğin 4.2.8.A numaralı maddesinin dördüncü fıkrasının (a) bendinde yer alan "çocuk metabolizma" ibaresinden sonra gelmek üzere ", çocuk endokrinolojisi ve metabolizma hastalıkları" ibaresi eklenmiş ve aynı fıkranın (b) bendi aşağıdaki şekilde değiştirilmiştir.
"b) İnme, kronik nörolojik bozukluklar ve baş boyun kanserleri ve cerrahi rezeksiyonda görülen yutma güçlüğü çeken yetişkin hastalarda; bu durumun belirtildiği nöroloji, kulak burun boğaz, genel cerrahi, beyin cerrahi, anestezi ve yoğun bakım, geriatri, tıbbi onkoloji, radyasyon onkolojisi uzmanlarından en az birinin bulunduğu sağlık kurulu raporuna istinaden tüm uzman hekimlerce reçete edilebilir. Raporda, ürünün adı, günlük kullanım miktarı açıkça belirtilerek aylık en fazla iki kutu yazılır."
MADDE 19 - Aynı Tebliğin 4.2.10 numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) 4.2.10.A-3 numaralı maddesinin birinci fıkrasında yer alan "Hasta adına," ibaresinden sonra gelmek üzere "çocuk endokrinolojisi ve metabolizma hastalıkları veya" ibaresi eklenmiştir.
b) 4.2.10.B-2 numaralı maddesinin birinci fıkrasında yer alan "gastroenteroloji," ibaresinden sonra gelmek üzere "çocuk endokrinolojisi ve metabolizma hastalıkları," ibaresi eklenmiştir.
c) 4.2.10.C-2 numaralı maddesinin birinci ve ikinci fıkralarında yer alan "çocuk metabolizma" ibarelerinden sonra gelmek üzere ", çocuk endokrinolojisi ve metabolizma hastalıkları" ibareleri eklenmiştir.
ç) 4.2.10.Ç-2 numaralı maddesinin birinci fıkrasında yer alan "çocuk metabolizma" ibaresinden sonra gelmek üzere ", çocuk endokrinolojisi ve metabolizma hastalıkları" ibaresi eklenmiştir.
d) 4.2.10.D-2 numaralı maddesinin birinci fıkrasında yer alan "çocuk metabolizma" ibaresinden sonra gelmek üzere ", çocuk endokrinolojisi ve metabolizma hastalıkları" ibaresi eklenmiştir.
e) 4.2.10.E numaralı maddesinin birinci fıkrasında yer alan "tedavisinde" ibaresi ile ikinci fıkrasında yer alan "en az bir" ibarelerinden sonra gelmek üzere "çocuk endokrinolojisi ve metabolizma hastalıkları veya" ibaresi ve aynı maddenin ikinci fıkrasında yer alan "dayanılarak" ibaresinden sonra gelmek üzere "çocuk endokrinolojisi ve metabolizma hastalıkları," ibaresi eklenmiştir.
MADDE 20 - Aynı Tebliğin 4.2.14.C numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Üçüncü fıkrasının (o) bendi aşağıdaki şekilde değiştirilmiştir.
"o) Erlotinib; epidermal büyüme faktörü reseptörü (EGFR) gen exon 19 delesyonu ve/veya exon 21 (L858R) mutasyonu, akredite bir laboratuvarda gösterilmiş metastatik nonskuamöz küçük hücreli dışı akciğer kanseri hastalarının birinci basamak tedavisinde ve yukarıda tanımlanan mutasyon ve delesyonu olan nonskuamöz küçük hücreli dışı akciğer kanseri hastalarında bir basamak kemoterapi sonu progresyonunda ikinci basamak tedavisinde progresyona kadar bu durumların belirtildiği tıbbi onkoloji uzmanının yer aldığı 6 ay süreli sağlık kurulu raporuna dayanılarak bu uzman hekimlerce veya göğüs hastalıkları uzman hekimlerince reçete edilir. Reçeteye genetik tetkik sonucu eklenir."
b) Üçüncü fıkrasının (t) bendinin (1) numaralı alt bendinde yer alan "KRAS" ibaresi "RAS" şeklinde değiştirilmiştir.
c) Üçüncü fıkrasının (y) bendinin (2) numaralı alt bendi aşağıdaki şekilde değiştirilmiştir.
"2) Skuamoz hücreli baş ve boyun kanseri endikasyonunda;
a) ECOG performans skoru 0-1 olan yassı hücreli nüks ya da metastatik nazofarenks dışı baş-boyun kanserlerinde birinci basamakta platin ve 5-Fluorourasil içeren kemoterapi rejimi ile kombine olarak kullanılır.
b) Sisplatin ile tedavi edilemeyen, kreatinin klirensi 55 ml/dk olan ve/veya orta-ileri derece kalp yetmezliği olan hastalarda lokal-ileri evre hastalıkta radyasyon tedavisi ile kombine olarak kullanılır.
Bu durumların belirtildiği en az bir tıbbi onkoloji uzmanının bulunduğu sağlık kurulu raporuna dayanılarak tıbbi onkoloji uzmanları tarafından reçete edilir."
ç) Üçüncü fıkrasına aşağıdaki bent eklenmiştir.
"jj) Arsenik trioksit: Pro-miyelositik lösemi /retinoik asit reseptör alfa (PML/RAR-alfa) geni varlığı ve/veya t(15;17) translokasyon varlığı ile karakterize relapslı/refrakter akut promiyelositik lösemili (APL) yetişkin hastalarda, remisyon indüksiyonu ve konsolidasyon (kurtarma tedavisi) için kullanılır. Önceki tedavi retinoid (ATRA) ve kemoterapi içermelidir. Diğer lösemi tiplerinde kullanılmaz. Bu durumların belirtildiği hematoloji uzman hekiminin yer aldığı tedavi protokolünü gösteren sağlık kurulu raporuna dayanılarak, yine bu uzman hekimlerce reçete edilebilir."
MADDE 21 - Aynı Tebliğin 4.2.15.D numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Maddenin başlığında yer alan "rivaroksaban" ibaresinden sonra gelmek üzere ", edoksaban" ibaresi eklenmiştir.
b) Aynı maddenin 4.2.15.D-1 numaralı alt maddesinin başlığında yer alan "rivaroksaban" ibaresinden sonra gelmek üzere ", edoksaban" ibaresi eklenmiştir.
c) Aynı maddenin 4.2.15.D-1 numaralı alt maddesinin birinci fıkrasının (a) ve (b) bentlerinde yer alan "apiksaban" ibarelerinden sonra gelmek üzere " veya edoksaban" ibaresi eklenmiştir.
MADDE 22 - Aynı Tebliğin 4.2.16 numaralı maddesinin ikinci fıkrasının (a) bendi aşağıdaki şekilde değiştirilmiştir.
"a) Çocuk metabolizma hastalıkları, çocuk endokrinolojisi ve metabolizma hastalıkları veya çocuk gastroenteroloji uzman hekimi tarafından, bu uzman hekimlerin bulunmadığı hastanelerde çocuk sağlığı ve hastalıkları uzman hekimlerince düzenlenen 1 yıl süreli uzman hekim raporuna dayanılarak,"
MADDE 23 - Aynı Tebliğin 4.2.23 numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Maddenin başlığında yer alan "posakonazol" ibaresinden sonra gelmek üzere "(oral süspansiyon ve tablet formu)" ibaresi eklenmiştir
b) Maddenin dördüncü fıkrasının (b) bendinin (1) numaralı alt bendinde yer alan "tedavisinde" ibaresinden sonra gelmek üzere "yalnızca oral süspansiyon formu kullanılır" ibaresi eklenmiştir.
MADDE 24 - Aynı Tebliğin 4.2.24.B numaralı maddesinin birinci fıkrasında yer alan ", vilanterol ve" ibaresi "ve vilanterol+flutikazon, vilanterol+umeklıdınyum, tiotropium+olodaterol" şeklinde değiştirilmiştir.
MADDE 25 - Aynı Tebliğin 4.2.27 numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) 4.2.27.A numaralı maddesinin üçüncü fıkrasında yer alan "4 doza" ibaresi "3 doza (3 dahil)" şeklinde değiştirilmiş ve aynı fıkrada yer alan "12 doza" ibaresinden sonra gelmek üzere "(12 dahil)" ibaresi eklenmiştir.
b) 4.2.27.A numaralı alt maddesine aşağıdaki fıkra eklenmiştir.
"(6) İmmün tolerans tedavisi (İTT); sadece üçüncü basamak sağlık hizmeti sunucularında, üç hematoloji uzman hekiminin yer aldığı 6 ay süreli sağlık kurulu raporuna dayanılarak, sadece hematoloji uzman hekimlerince reçete edilebilir. İTT tedavisi açısından maksimum tedavi süresi 1 yıldır. Tedavi süresinin tamamlanması sonrasında hastanın İTT tedavisine vermiş olduğu yanıtın belirtildiği sağlık kurulu raporu da düzenlenecektir. Hastanın takip ve tedavi edildiği sağlık kurumlarında, hastalar adına dosyalar açılacak ve tüm bilgiler istendiğinde Kuruma ibraz edilmek üzere bu dosyada muhafaza edilecektir.
a) Tedaviye başlama kriterleri; 11 (on bir) yaşından gün almamış, faktör düzeyi %1 ve altında, inhibitör titresi de 10 BU (bethesda ünitesi) (10 değeri dahil) arasında olan HR titrajlı inhibitörlü hemofili-A tanılı hastalarda İTT' ne başlanabilir. İTT için kötü yanıt kriterleri taşıyan hastalarda (inhibitör tanısı üzerinden 5 yıl geçmiş olması veya tepe inhibitör titresinin 200 BU/ml'nin üzerinde olması) İTT tedavisi Kurumca karşılanmaz (Bu kriterlerin raporda belirtilmesi gerekir.).
b) İTT uygulama doz ve süresi;
1) İmmun tolerans tedaviye haftada 3 kez 50 IU/kg dozunda en az 6 ay süreyle uygulanacak şekilde başlanır. İlaçlar aylık dozlar halinde reçete edilir. Bu süre sonunda FVIII:C aktivitesi ve inhibitör titresine bakılır. %20 ve üzerinde inhibitör titresinde azalma olması halinde bu durumun raporda belirtilmesi koşuluyla 6 ay süreli yeni rapor düzenlenerek tedaviye devam edilebilecektir. FVIII:C aktivitesinin % 66 olarak saptanması durumunda İTT tedavisi sonlandırılacak olup, bu hastalarda Tebliğin 4.2.27 nci maddesi kapsamında tedaviye devam edilecektir.
2) İTT tedavisi esnasında akut kanaması ve/veya cerrahi girişim gerekli olan hastalarda mevcut bypass edici ajanlar ile SUT hükümleri doğrultusunda kanama tedavisi uygulanabilir ve aynı zamanda İTT tedavisi de sürdürülür. Bu tedaviler dışında İTT tedavisi görmekte olan hastalara bypass edici ajanlar kullanılmaz. Tedaviye 10 (on) günden fazla ara verildiği takdirde İTT tedavisine devam edilmeyecek olup, bu hastalarda Tebliğin 4.2.27 nci maddesi kapsamında tedaviye devam edilecektir. Söz konusu tedaviler için endikasyon uyumu aranacaktır."
c) 4.2.27.D numaralı maddesi aşağıdaki şekilde değiştirilmiştir.
"4.2.27.D - Eltrombopag kullanım ilkeleri
4.2.27.D.1- İmmün trombositopenik purpura endikasyonunda eltrombopag kullanım ilkeleri
(1) Diğer tedavilere (kortikostreoid ve immünoglobulinler ve splenektomiye) dirençli ya da kortikostreoid ve immünoglobulinlere dirençli ve splenektominin kontrendike olduğu/yapılamadığı ya da splenektomi sonrası nüks eden durumlarda, 1 yaşından itibaren trombosit sayısı 30.000'in altında olan kanamalı kronik immün trombositopenik purpura hastalarında tedaviye başlanır.
(2) 1-5 yaş arası pediyatrik popülasyonda başlangıç dozu günde bir kez 25 mg, 6-17 yaş arası pediyatrik popülasyon ile erişkin popülasyonda başlangıç dozu günde bir kez alınan 50 mg'dır. 2 haftalık tedaviye rağmen trombosit sayısının 50.000'in altında olması durumunda doz 75 mg'a çıkarılabilir. Trombosit sayısının 150.000'i aşması durumunda günlük tedavi dozu 25 mg basamaklarla azaltılmalıdır. Her doz değişikliğinde trombosit sayısı raporun açıklama bölümünde belirtilir.
(3) Trombosit sayısının 250.000 üzerine çıkması veya günlük 75 mg' lık tedavi dozuna rağmen 4 haftalık tedavi sonrası trombosit sayısının 30.000' in altında kalması durumunda tedavi sonlandırılır.
(4) Trombosit sayısı 250.000' i aştığı için tedavisi kesilen vakalarda trombosit sayısı 100.000 ve altına düştüğünde 25 mg' lık günlük doz ile tedaviye yeniden başlanır.
(5) Bu durumların belirtildiği, hematoloji uzman hekimi tarafından düzenlenen 6 ay süreli uzman hekim raporuna dayanılarak bu uzman hekimlerce reçete edilir. Raporda kullanılacak ilaç/ilaçların kullanım dozu, uygulama planı ve süresi yer alır. Yenilenen her raporda hastanın bir önceki raporunda yer alan trombosit değerleri ve ayrıca tedaviye başlangıç kriterleri ve başlangıç tarihi belirtilir.
4.2.27.D.2- Kazanılmış ağır aplastik anemi endikasyonunda eltrombopag kullanım ilkeleri
(1) Önceki immün sistemi baskılayıcı tedaviye dirençli olan ve yoğun ön tedavi görmüş olup allojenik kök hücre transplantasyonu için uygun olmayan ve hayatı tehdit eden organ kanaması olan, trombosit sayısı < 20.000 olan edinsel şiddetli aplastik anemili (SAA) erişkin hastalarda tedaviye başlanır.
(2) Tedaviye başlandıktan sonra etkin dozu almasına rağmen 12 hafta sonunda trombosit sayısı 20.000' in altında ise ilaç kesilir. Transfüzyon ihtiyacı olmayan ve trombosit sayısı 20.000' in üzerinde olan hastalarda ilaca devam edilebilir. Tedavi sırasında hasta trombosit transfüzyonuna bağımlı olursa ve hematolojik yanıt kaybı olursa ilaç kesilir.
(3) Bu durumların belirtildiği üçüncü basamak hastanelerde hematoloji uzman hekiminin yer aldığı üç ay süreli sağlık kurulu raporuna dayanılarak hematoloji uzman hekimlerince reçete edilir. Her doz değişikliğinde trombosit sayısı raporun açıklama bölümünde belirtilir. Her raporda hastanın transfüzyona bağımlı olmadığı ve hematolojik yanıt kaybı oluşmadığı belirtilir."
MADDE 26 - Aynı Tebliğin 4.2.28.A numaralı maddesinin başlığında yer alan "antihipertansiflerle" ibaresinden sonra gelmek üzere "veya asetilsalisilikasitle" ibaresi eklenmiştir.
MADDE 27 - Aynı Tebliğin 4.2.33.A numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Maddenin ikinci fıkrası aşağıdaki şekilde değiştirilmiştir.
"(2) Ranibizumab ve aflibersept; hasta anamnezi, FFA (kontrendikasyonu yoksa) ve lezyona ait renkli resim ve/veya OKT varlığına ait bilgiler 3 ay süreli sağlık kurulu raporunda belirtilerek 4 (dört) ila 6 (altı) hafta arayla 3 kez yükleme dozuyla başlanır. Yükleme dozları arasındaki sürenin hastaya bağlı sebeplerle 6 (altı) haftanın üzerine çıkması söz konusu olduğu takdirde bu durumun belirtildiği sağlık kurulu raporuna istinaden 4-6 hafta ara ile yükleme dozunun yeniden tekrarlanması gerekmektedir. Yükleme dozunun tamamlanması sonunda hastalar izlenerek göz dibi bulguları, görme keskinliği ve optik koherens tomografileri (OKT) değerlendirilir. Tedavinin devamında bu bulgular ve tedaviye devam kararı her uygulama için düzenlenecek yeni sağlık kurulu raporunda belirtilir. Devam tedavisi, ilacın Sağlık Bakanlığınca ruhsatlı endikasyonu/kullanım şeklinde yer alan esaslar doğrultusunda sürdürülecektir. Tedaviye alınan olumlu cevaba göre Sağlık Bakanlığınca ruhsatlı endikasyonu/kullanım şeklinde yer alan esaslar doğrultusunda tedaviye ara verilmesi durumunda yeniden tedavi, başlangıç kriterlerine uygun olarak düzenlenmiş sağlık kurulu raporuna istinaden ara vermeden önce kullanılan ilaç ile mümkündür. Bu durumda yeniden yükleme dozu şartı aranmayacaktır. Tedavide ilaç değişimi bir defaya mahsus olmak üzere, ilk tedaviye başlanan ilaç ile yükleme dozu tamamlandıktan sonra devam edecek tedaviler esnasında yapılacak değerlendirme sonucuna göre, hekim tarafından uygun görülen durumda başlangıç kriterlerine uygun olarak düzenlenmiş, değişimin gerekçesinin belirtildiği sağlık kurulu raporu ile mümkün bulunmaktadır. İlaç değişimi yapıldığında yeniden yükleme dozu yapılması şartı aranmayacaktır. Yükleme dozu tamamlanmaksızın ilaç değişimi hasta bazında Sağlık Bakanlığı endikasyon dışı ilaç kullanımı onayına istinaden mümkündür."
b) Maddenin üçüncü fıkrasının sonuna aşağıdaki cümle eklenmiştir.
"Farklı göze kullanımlar kombine kullanım olarak değerlendirilmez."
MADDE 28 - Aynı Tebliğin 4.2.33.B numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Maddenin ikinci fıkrasında yer alan "birer ay" ibaresi "4 (dört) ila 6 (altı) hafta" şeklinde değiştirilmiştir.
b) Maddeye aşağıdaki fıkralar eklenmiştir.
"(5) Bu grup ilaçlar kombine olarak kullanılamayacaktır. Farklı göze kullanımlar kombine kullanım olarak değerlendirilmez.
(6) Bu grup ilaçlar yalnızca ayakta tedavi kapsamında ödenecektir."
MADDE 29 - Aynı Tebliğin 4.2.33.C numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Maddenin birinci ve ikinci fıkralarında yer alan "FFA" ibarelerinden sonra gelmek üzere "(kontrendikasyonu yoksa)" ibaresi eklenmiştir.
b) Maddeye aşağıdaki fıkra eklenmiştir.
"(4) Bu grup ilaçlar kombine olarak kullanılamayacaktır. Farklı göze kullanımlar kombine kullanım olarak değerlendirilmez."
MADDE 30 - Aynı Tebliğin 4.2.33.D numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Maddenin ikinci, üçüncü ve dördüncü fıkraları aşağıdaki şekilde değiştirilmiştir.
"(2) Ranibizumab tedavisine, 3 ay süreli sağlık kurulu raporunda belirtilerek 4 (dört) ila 6 (altı) hafta arayla 3 kez yükleme dozuyla, aflibersept tedavisine 5 ay süreli sağlık kurulu raporunda belirtilerek 4 (dört) ila 6 (altı) hafta arayla en az 3 en fazla 5 doza kadar yükleme dozuyla başlanır. Deksametazon intravitreal implant için yükleme dozu uygulaması bulunmamaktadır. Yükleme dozları arasındaki sürenin hastaya bağlı sebeplerle 6 (altı) haftanın üzerine çıkması söz konusu olduğu takdirde bu durumun belirtildiği sağlık kurulu raporuna istinaden 4-6 hafta ara ile yükleme dozunun yeniden tekrarlanması gerekmektedir.
(3) Yükleme dozunun tamamlanması sonunda hastalar izlenerek göz dibi bulguları, görme keskinliği ve optik koherens tomografileri (OKT) değerlendirilir. Tedavinin devamında bu bulgular ve tedaviye devam kararı her uygulama için düzenlenecek yeni sağlık kurulu raporunda belirtilir. Devam tedavisi, ilacın Sağlık Bakanlığınca ruhsatlı endikasyonu/kullanım şeklinde yer alan esaslar doğrultusunda sürdürülecektir. Tedaviye alınan olumlu cevaba göre Sağlık Bakanlığınca ruhsatlı endikasyonu/kullanım şeklinde yer alan esaslar doğrultusunda tedaviye ara verilmesi durumunda yeniden tedavi, başlangıç kriterlerine uygun olarak düzenlenmiş sağlık kurulu raporuna istinaden ara vermeden önce kullanılan ilaç ile mümkündür. Bu durumda yeniden yükleme dozu şartı aranmayacaktır.
(4) Ranibizumab ve aflibersept arasında ilaç değişimi bir defaya mahsus olmak üzere, ilk tedaviye başlanan ilaç ile yükleme dozu tamamlandıktan sonra devam edecek tedaviler esnasında yapılacak değerlendirme sonucuna göre, hekim tarafından uygun görülen durumda başlangıç kriterlerine uygun olarak düzenlenmiş, değişimin gerekçesinin belirtildiği sağlık kurulu raporu ile mümkün bulunmaktadır. İlaç değişimi yapıldığında yeniden yükleme dozu yapılması şartı aranmayacaktır. Yükleme dozu tamamlanmaksızın ilaç değişimi hasta bazında Sağlık Bakanlığı endikasyon dışı ilaç kullanımı onayına istinaden mümkündür."
b) Maddenin beşinci fıkrasının sonuna aşağıdaki cümle eklenmiştir.
"Farklı göze kullanımlar kombine kullanım olarak değerlendirilmez. Deksametazon intravitreal implant, ranibizumab ve aflibersept etkin maddeli ilaçlar ile aynı gün içerisinde olmamak kaydıyla uygulanabilecektir. (Aynı gözde diyabetik maküler ödemde 7 implanttan fazla tekrar edilmesi gereken durumlar için hasta bazında Sağlık Bakanlığı endikasyon dışı ilaç kullanımı onayı aranır.)"
MADDE 31 - Aynı Tebliğin 4.2.38 numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Maddenin üçüncü fıkrası aşağıdaki şekilde değiştirilmiştir.
"(3) Analog insülinler, pioglitazon, pioglitazonun oral kombinasyonları veya pioglitazonun insülin ile kombine kullanımları endokrinoloji, iç hastalıkları, çocuk sağlığı ve hastalıkları ve kardiyoloji uzman hekimlerince veya bu hekimlerce düzenlenen uzman hekim raporuna dayanılarak tüm hekimlerce reçete edilebilir.
a) 300 IU/ml insülin glarjin içeren ilaçlar; günlük insülin ihtiyacı yüksek olan (100 IU/gün) veya uzun etkili insülin kullandığı halde gece hipoglisemi riski yüksek olan veya brittle tip 1 diyabeti olan hastalarda bu durumun belirtildiği en az bir endokrinoloji uzman hekiminin yer aldığı sağlık kurulu raporuna dayanılarak endokrinoloji veya iç hastalıkları uzman hekimlerince reçete edilebilir.
b) İnsülin degludek+insülin aspart kombinasyonu; analog karışım veya uzun etkili insülinlerden birini kullanmış olmasına rağmen kan şekeri labil seyreden ve/veya sık hipoglisemik olay geçiren ve/veya hipoglisemi riski yüksek ya da regülasyon sağlanamayan hastalarda bu durumun belirtildiği en az bir endokrinoloji uzman hekiminin yer aldığı sağlık kurulu raporuna dayanılarak endokrinoloji veya iç hastalıkları uzman hekimlerince reçete edilebilir."
b) Maddenin dördüncü fıkrasında yer alan "linagliptin" ibaresinden sonra gelmek üzere ", alogliptin" ibaresi eklenmiştir.
MADDE 32 - Aynı Tebliğin 4.2.46 numaralı maddesinin birinci fıkrasında yer alan "Pirfenidon" ibaresinden sonra gelmek üzere "ve Nintedanib" ibaresi ve aynı maddeye aşağıdaki fıkralar eklenmiştir.
"(2) Pirfenidon ve Nintedanib etken maddesini içeren ilaçlar;
a) Bağ dokusu belirteçleri açısından romatoloji konsültasyonu alınmış, IPF tanısı biyopsi ile ve/veya aşağıda belirtilen uluslararası kriterlere göre konmuş olan hastalarda tedaviye başlanır.
1) Toraks yüksek çözünürlüklü bilgisayarlı tomografi (HRCT) raporu, (raporun tarih ve sayısının sağlık kurulu raporunda belirtilmiş olması)
2) Karbonmonoksit difüzyon kapasitesini (DLCO) de içeren ayrıntılı solunum fonksiyon testleri (DLCO-DLCO/VA-DLCO/VA/ADJ değerlerinin raporda belirtilmesi ve DLCO/VA/ADJ değerinin %30-90 arası olması.
b) Tedavinin devamı için hasta 6 ayda bir değerlendirilir. DLCO/VA/ADJ değerinde atak dönemi dışındaki ölçümde başlangıca göre %15 düşme (progresyon) olması halinde tedavi kesilir. Tedavinin devamı için başlangıca göre %15 düşme olmadığı her raporda belirtilmelidir.
Bu durumların belirtildiği üçüncü basamak sağlık kurumlarında üç göğüs hastalıkları uzman hekiminin yer aldığı 6 ay süreli sağlık kurulu raporuna dayanılarak tüm göğüs hastalıkları uzman hekimlerince reçetelenir.
(3) Pirfenidon ve Nintedanib etken maddeleri arasında tedavi geçişlerinde; tedaviye yanıtsızlık (progresyon) kriteri veya intolerans şartı (ilaca bağlı yan etki) aranır. Bu durum sağlık kurulu raporlarında belirtilmelidir."
MADDE 33 - Aynı Tebliğin 4.2.47 numaralı maddesinin birinci fıkrasında yer alan "süreli" ibaresinden sonra gelmek üzere "çocuk endokrinolojisi ve metabolizma hastalıkları ve/veya" ibaresi eklenmiştir.
MADDE 34 - Aynı Tebliğin 4.2.48 numaralı maddesinin birinci fıkrasında yer alan "çocuk endokronoloji," ibaresinden sonra gelmek üzere "çocuk endokrinolojisi ve metabolizma hastalıkları," ibaresi eklenmiştir.
MADDE 35 - Aynı Tebliğin 4.2.49 numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Birinci fıkrasında yer alan "6" ibaresi "4" şeklinde değiştirilmiştir.
b) Üçüncü fıkrasının (c) ve (ç) bentleri aşağıdaki şekilde değiştirilmiştir.
"c) Bu maddenin üçüncü fıkrasının (a) ve (b) bentlerinde belirtilen kriterlere uyan hastalara (invaziv/non invaziv mekanik solunum desteği ihtiyacı olup olmadığına bakılmaksızın) tedavi başlanır. Tedavi sürecinde SMA' dan kaynaklı invaziv mekanik solunum desteği ihtiyacı geliştiği saptanan veya invaziv mekanik solunum desteği ihtiyacı devam eden hastalarda tedaviye son verilir. Enfeksiyon vb. durumlardan dolayı invaziv mekanik solunum desteği alan ve sebep ortadan kalktıktan sonra solunum desteği ihtiyacı kalkan hastalarda tedavi kesilmez.
ç) Sağlık Bakanlığınca hastaların klinik değerlendirmelerini yapmak üzere değerlendirme ekipleri oluşturulur, değerlendirme kriterleri ve hasta takiplerinin yapılacağı merkezler belirlenir. Hastaların klinik değerlendirmeleri belirlenen kriterler çerçevesinde ve periyotta bu merkezlerdeki sorumlu hekimler ve değerlendirme ekiplerince yapılır. Hastaların klinik değerlendirmelerinde Hammersmith Infant Neurological Examination (HINE) veya Hammersmith Functional Motor Scale Expanded (HFMSE) veya The Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders (CHOP INTEND) adı verilen nörolojik ve motor skalalar kullanılır. Değerlendirme sonrası raporlar, "Sağlık Bakanlığı-Türkiye İlaç ve Tıbbi Cihaz Kurumu İlaçların Kişisel Tedavide Kullanılmalarını Değerlendirme Komisyonu" na sunulur. Tedaviyi sonlandırma veya tedaviye devam etmeye dair nihai karar bu komisyon tarafından verilir."
MADDE 36 - Aynı Tebliğin 4.3 numaralı maddesinin sekizinci fıkrasının ikinci cümlesinden sonra gelmek üzere aşağıdaki cümle eklenmiştir.
"Ancak, Sağlık Bakanlığınca ilaca verilen perakende satış fiyatı nedeniyle, bu fıkra kapsamında yapılan hesaplama sonucu bulunacak tutarın fazla olması halinde, bu durumdaki ilaca ilişkin MEDULA sistemi kayıtları, EK-4/C'de kayıtlı fiyatının EK-4/A Listesine giriş talep tarihindeki T.C. Merkez Bankası efektif döviz satış kuru üzerinden TL karşılığına çevrilerek SUT'un 4.4.1 maddesinde tanımlı baz iskontonun uygulanmasını müteakip bulunacak tutar üzerinden yapılır."
MADDE 37 - Aynı Tebliğin 5.2.4 numaralı maddesinin ikinci fıkrasında aşağıdaki düzenlemeler yapılmıştır.
a ) Fıkranın (a) ve (c) bentlerinde yer alan "60/c-1, 60/c-3 veya 60/c-9" ibareleri "60/c-1 veya 60/c-3" şeklinde değiştirilmiştir.
b) Fıkranın (f) bendinde yer alan "manuel olarak" ibaresi yürürlükten kaldırılmıştır.
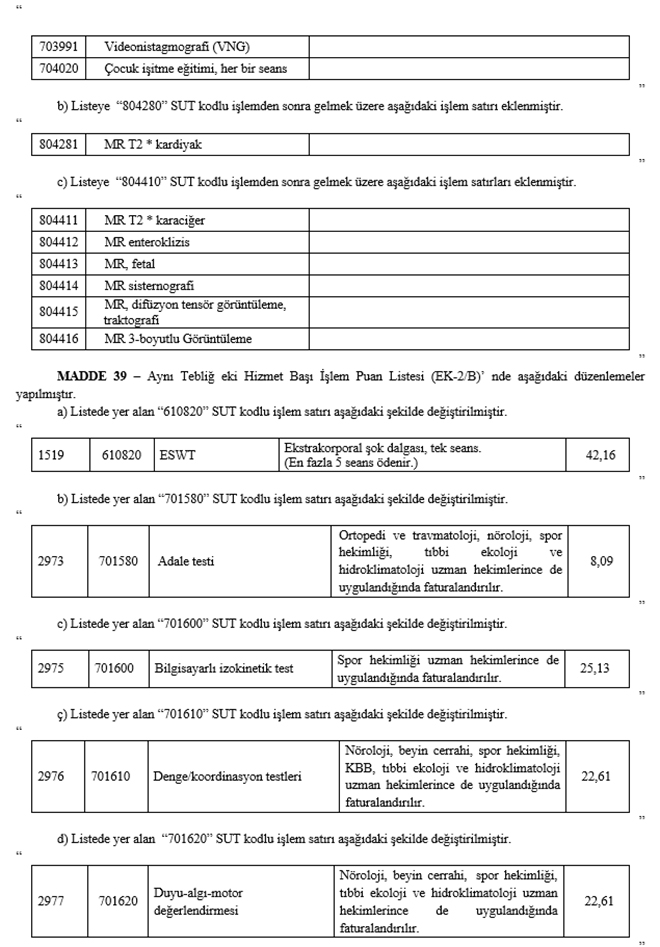
MADDE 38 - Aynı Tebliğ eki Ayaktan Başvurularda İlave Olarak Faturalandırılabilecek İşlemler Listesi (EK-2/A-2)' nde aşağıdaki düzenlemeler yapılmıştır.
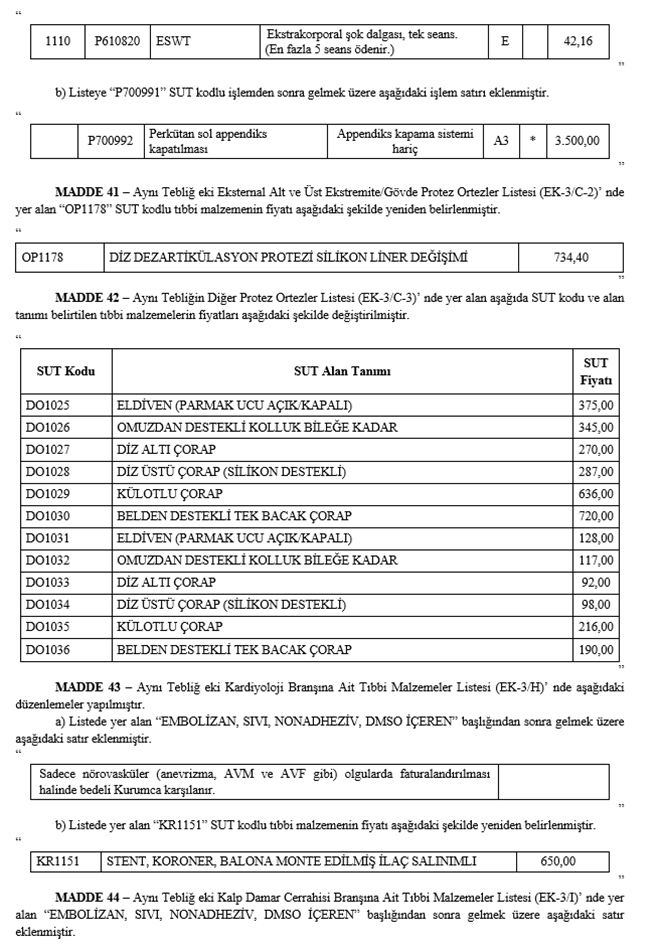
a) Listeye "703810" SUT kodlu işlemden sonra gelmek üzere aşağıdaki işlem satırları eklenmiştir.
"